Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe auch Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Neben den schon besprochenen Formen von „Impingement-Symptomen“ des Schulter-Nebengelenkes (Subacromialraum), kann es auch zu arthrogenen Einklemmmechanismen des glenohumeralen Gelenkes kommen.
Das Anterosuperiore Impingement (ASI) beschreibt eine Einklemmung zwischen dem Tuberculum minus und dem vorderen Glenoidrand.
Habermeyer et al. beschreiben den genauen Pathomechanismus des ASI nachfolgend:
1. Einriss des Lig. glenohumerale superius
2. Subluxation der LBS
3. Abschilferung des SSC und SSP
4. Einklemmung (Impingement) von: LBS, Lig. glenohumerale und SSC zwischen Tuberculum minus und Glenoidrand (ASI)
Das Posterosuperiore Impingement (PSI) beschreibt die Einklemmung von Strukturen zwischen dem Tuberculum majus und dem hinteren Glenoidrand.
Nach Jobe (1995) können dadurch folgende 5 Strukturen geschädigt werden:
1. Craniales Labrum
2. Sehnen der ROMA
3. Tuberculum majus
4. Inferiores glenohumerales Ligament
5. Cranialer Anteil des Glenoids
Im Gegensatz zu den subacromialen Impingement-Formen sind hier vor allem junge, athletische Patienten betroffen. Oft lassen sich in der Anamnese repetitive Überkopfbewegungen (z.B. Tennis, Baseball, Speer, Schwimmen) feststellen und es wird über dorsalen Schulterschmerz geklagt.
ASI: Im MSU lässt sich in der dynamischen Untersuchung die Subluxation der LBS erkennen (fehlende Sehne im Sulcus und ründliche Struktur medial des Humerus). Bei der statischen Untersuchung ist die Sehne verbreitert und eventuell hypoechogen ummantelt, was als „Biceps-Halo“ bezeichnet wird.
Des Weiteren können Inhomogenitäten im Bereich des Supraspinatus- und Subscapularis-Ansatzes auf eine partielle Läsion hinweisen (Habermeyer 2003).
Zusammenfassend kann man sagen, dass Habermeyer die Pulley-Läsion als Ursache für ein entstehendes glenohumerales Impingement ansieht.
Das auslösende Bewegungsmuster ist eine horizontale Adduktion mit Innenrotation, unter aktiver Bicepsanspannung mit entstehenden Scherkräften.
Le Huec (1996) und Dumontier (1999) sahen dagegen bei einer horizontalen Adduktion und Innenrotation ein extraartikuläres Impingement zwischen Humerus und Processus Coracoideus.

Ergänzung zu den 4 SLAP-Typen nach Snyder (siehe Region 3/ SLAP-Läsionen!):
Typ-SLAP-5-Läsionen: SLAP 2 Risse mit einem Übergang in eine Bankart-Läsion.
Typ-SLAP-6-Läsionen: SLAP 2 Risse mit einem lappenförmigen Ausriss.
Typ-SLAP-7-Läsionen: SLAP 2 Risse deren Rissverlauf in das mediale, stabilisierende Kapselband (in die ventrale Schulterkapsel) mündet.
Es sind somit diverse Verletzungsmuster des Labrum glenoidale möglich und die aufgezeigten Läsionstypen stellen die häufigsten Varianten dar.
Symptomatik:
Es ist typisch für SLAP-Läsionen, dass sie eine bunte und für den Patienten, wie auch Untersucher, unklare Symptomatik verursachen.
Oft findet sich ein Trauma oder Sturz in der Vorgeschichte mit dem die Schulterprobleme begonnen haben. Ein Knacken oder Schnappen in der Schulter kann ein Hinweis sein.
Manche Patienten verspüren ein Instabilitätsgefühl, als hake die Schulter bei bestimmten Bewegungen ein und aus.
Der Schmerz wird von dem Betroffenen tief in der Schulter empfunden. Bei Aktivität wird der Schmerz in der Regel schlimmer.
Der obere Labrumkomplex mit seiner anatomischen Varianz stellt diagnostische und therapeutische Herausforderungen an den Untersucher und Behandler, insbesondere weil eine Abgrenzung von pathologischen SLAP-Läsionen schwierig ist. Das Labrum glenoidale besteht aus überwiegend ringförmig angeordneten kollagenen Fasern.
Seine Befestigung am Knochen erfolgt über eine faserknorpelige Übergangszone und ist im unteren Teil sehr fest, im oberen Teil aber variabel ausgeprägt. Auf der anderen Seite geht das Labrum direkt in die Gelenkkapsel und die umgebenden Sehnen und Bänder über. Die funktionell wichtigen Fasern der LBS inserieren nicht nur am Tuberculum supraglenoidale, einige Fasern strahlen auch variabel direkt in das Labrum ein. Ablösungen in diesem Bereich (SLAP-Läsionen) sind von "normalen", anatomischen Spaltbildungen, wie dem Foramen sublabrale (in bis zu 18% der Fälle) oder der Extremvariante, dem Buford-Komplex (bis zu 6% der Fälle) zu unterscheiden.
(Quellen: Aus der Abteilung für Schulter – und Ellbogenchirurgie der Atos Klinik Heidelberg
Prof. Dr. med. habil. Peter Habermeyer,Antero superiores Impingement der Schulter als Folge von Pulley
Läsionen: Verletzungsmuster und arthroskopische Therapie. Eine prospektive Untersuchung. Dissertation zum Erwerb des Doktorgrades der Medizin an der Medizinischen Fakultät der Ludwig-Maximilians-Universität zu München, vorgelegt von Michael Held aus München Jahr 2008. Mit Genehmigung der Medizinischen Fakultät der Universität München,Berichterstatter: Prof. Dr. med. habil. Peter Habermeyer, Mitberichterstatter: Prof. Dr. W. Hartl
Prof. Dr. K. - G. Kunze, Prof. Dr. H. R. Dürr, Mitbetreuung: Dr. med. Petra Magosch, Dekan: Prof. Dr. med. D. Reinhardt
Kibler WB et al, Current practice for the diagnosis of a SLAP lesion: systematic
review and physician survey, Arthroscopy, 31(12):246-2469, 2015/ Kibler WB, et al, Current practice for the surgical treatment of SLAP lesions: a systematic
review, Arthroscopy, 32(4):669-683, 2016
Snyder SJ, et al, SLAP lesions of the shoulder, Arthroscopy, 6:274-278, 1990
Erickson BJ, et al, SLAP lesions: trends in treatment, Arthroscopy, 32(6):976-981, 2016
Der Orthopäde, Springer Link July 2003, Volume 32, Issue 7, pp 572–577 | Cite as
Die Anatomie des oberen Labrumkomplexes im Schultergelenk, Autoren: T. Tischer, R. Putz ,Anatomische Anstalt Lehrstuhl I, München, Zum Thema: Bizeps-Labrum-Komplex)
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Schulterinstabilitäten werden unterschiedlich klassifiziert. Zunächst trennt man akute und chronische Instabilitäten.
Hinsichtlich des Verrenkungsmechanismus unterteilt man in anteriore, dorsale/posteriore, inferiore/caudale, craniale/“Luxatio erecta“, sowie multidirektionale Luxationen.
Instabilitäten, die nur eine Richtung betreffen werden als „unidirektionale Instabilitäten“ bezeichnet und machen 90% der Ereignisse aus.
Instabilitäten können traumatisch oder habituell (gewohnheitsmäßig) auftreten. Die Verrenkung der Schulter kann Schäden am Labrum hinterlassen, die man Bankart-Läsionen nennt und nach Schwere in drei Grade einteilt. Bei der schwersten Form ist eine knöcherne Verletzung der Cavitas Glenoidale beteiligt (sog. ossäre Bankart-Läsion).
Weil der im Verhältnis zum kleinen Glenoid relativ große Humerus im Moment der Ausrenkung tangential am Glenoid vorbeischlägt, nimmt er auf diesem Weg Teile des Labrums oder ossäre Bestandteile der Schulterpfanne mit. So können hier Schäden entstehen.
Insbesondere die Größe und Anzahl der Fragmente, die Gelenk- und Frakturstellung nach Reposition, sowie patientenspezifische Faktoren wie das jeweilige Aktivitätsniveau und Alter sind therapieweisend. Akute Bankart-Läsionen mit kleinen Fragmenten (<15% des Glenoids) können häufig konservativ therapiert werden, sofern sich das Schultergelenk nach der Reposition radiologisch zentriert zeigt.
Bei größeren Defekten oder chronischer Instabilität kann es zur operativen Indikation kommen.
Eine gebräuchliche Klassifikation der Luxationen stellt z.B. die Polar Klassifikation nach Blaley dar:
Typ Polar 1: traumatische, strukturelle Luxation
Typ Polar 2: nicht traumatische , aber strukturelle Schäden
Typ Polar 3: habituelle, nicht strukturelle Luxationen (Muskuläre Dysbalancen)
Das Schultergelenk wird durch die Muskulatur, die Gelenkkapsel und den umliegenden Bandapparat stabilisiert. Zudem stabilisieren das flächenvergrößernde Labrum glenoidale, wirkende Adhäsivkräfte, bzw. Unterdruck und statische Kontaktkräfte, wie die knöcherne Formgebung.
Die kleine Cavitas glenoidale kann so mit dem großen Humeruskopf einen großen Bewegungsspielraum zur Verfügung stellen und trotzdem ausreichende Stabilität gewähren. Das muntere multistrukturelle Zusammenspiel macht die Schulter aber auch anfälliger für Störungen, wie Instabilitäten. Kommt es z.B. zu einem Sturzereignis, so ereignet sich oft eine ventro-caudale Verletzung des Labrums (Bankart-Läsion). Hierbei sind dann meist auch die ventro-caudale Kapsel, sowie die angrenzenden Ligamente beteiligt. Die habituellen Subluxationen oder Luxationen ereignen sich aufgrund anlagebedingter Faktoren, wie elastischem, weichem muskuloskelettalem System (Muskulatur, Bindegewebe/Faszien, Sehnen, Bänder). Das Gelenk hat dadurch keine ausreichende Stabilität, so dass Gelegenheitstraumen zum Verrenken der Schulter führen können. Die traumatischen Luxationen sind aber für die Mehrzahl der Luxationen verantwortlich.
Eine „Erstausrenkung“ infolge eines Traumas wird oft noch Jahre zurück in Erinnerung bleiben, da es meist als einschneidendes Ereignis empfunden wird. In Abhängigkeit von den ausgelösten Schäden kann sich daraus eine chronische Instabilität entwickeln. Manche Patienten erleiden so mehrere Subluxationen oder Luxationen. Das Labrum kann beschädigt werden, die stabilisierenden Ligamente überdehnen oder reißen und Fragmente aus dem Glenoid ausbrechen.
Auch repetitive Mikrotraumen können eine Instabilität herbeiführen, insbesondere bei „Überkopfsportarten“. Kommt es infolge der Instabilität zu Rissen im Rotatorenintervall und einer partiellen Ruptur an der Unterfläche der ISP, so bezeichnet man es als APIT-Läsion (Antero-Posterior Instability „Throwing Athlet“).
Im SFT-Konzept kann man klinische Test verwenden und sonografische Hinweise auf Begleitverletzungen finden. Zudem lässt sich infolge der frischen Einblutung bei akuten Traumen ein Gelenkerguss nachweisen.
Eine etwaige knöcherne Beteiligung des Humeruskopfes kann sichtbar gemacht werden. Diese Verletzung wird als Hill-Sachs-Läsion und die ossäre Einbuchtung als Hill-Sachs-Delle bezeichnet. Eine genauere knöcherne Darstellung muss dann im CT erfolgen.
Die Hill-Sachs-Läsion ist häufig ein Zeichen rezidivierender Luxationen. Je nach Richtung der Luxation findet sich der Humerusdefekt. So führt eine ventrale Luxation zu einem dorso-lateralen Hill-Sachs-Defekt und eine dorsale Luxation zu einem ventro-cranialen Hill-Sachs-Defekt.
Der Defekt nach dorsaler Luxation wird als inverse Hill-Sachs-Läsion bezeichnet. Meist erfolgt dieses zusammen mit einer Bankart-Läsion.
Die Schulter-ASK ist der eventuell erforderliche und zugleich diagnostische Goldstandard und kann dabei mit der therapeutischen Maßnahme verbunden werden.
Liegen willkürliche Ausrenkungen vor (der Patient kann sich selber die Schulter schmerzfrei luxieren), sollte der Patient aufgefordert werden diese dauerhaft zu unterlassen. Die Selbst-Ausheilung nach Jahren kann bei diesen Patienten besser sein, als Operationsergebnisse.
Bei den Operationsmethoden finden sich in der Literatur über 100 stabilisierende Verfahren.
Konservative und operative Maßnahmen schützen die Schulter zugleich vor Luxations-Komplikationen.
So ist insbesondere der Nervus axillaris gefährdet, bei einer Verrenkung eingeklemmt oder geschädigt zu werden. Zudem kann jede Folgeluxation nicht nur schmerzhaft sein, sondern auch zur fortschreitenden Zerstörung des Gelenks, bis hin zur Arthrose führen.
Stabilisierende Maßnahmen führen zu einem hohen Zufriedenheitsgrad der Patienten (je nach Studie 75-100%). Das postoperative Rezidiv- Risiko liegt bei etwa 10%.
(Quellen: 1. Monk AP, et al, Evidence in managing traumatic anterior shoulder instability: a scoping review, Br J Sports
Med, 49(5):307-311, 2015, doi: 10.1136/bjsports-2013-092296.
2. Plancher KD, et al, Analysis of evidence-based medicine for shoulder instability, Arthroscopy, 25(8):897-908, 2009, doi: 10.1016/j.arthro.2009.03.017.)

MRT der Schulter. Im hinteren seitlichen Abschnitt des Oberarmkopfes kommt eine sogenannte Hill-Sachs-Delle zur Darstellung. Diese Delle ist typisch für einen Zustand nach Schulterluxation.
Quelle: Wikimedia commons
Urheber: Braegel (22.04.2012)
Weitere Verwendung gemäß der Bestimmungen von Wikimedia commons legitimiert.

Hintere Schulterluxation in der Computertomographie axial und im Röntgen. Man erkennt gut, wie der Humeruskopf am hinteren Rand des Glenoids verhakt ist und hier eine ossäre Impression, eben eine inverse oder reverse Hill-Sachs-Läsion (oder Delle) entstanden ist.
Quelle (Link zu Lizenz und Urheber): Wikimedia commons
dortiger Autor: Hellerhoff (14.04.15)
Die Datei darf gemäß der Bestimmungen von Wikimedia commons weiter verwendet werden.

Hintere Schulterluxation im Röntgenbild (links) mit dem so genannten "light-bulb-sign" oder Glühbirnenzeichen. Der Humeruskopf ist durch die Verkantung am hinteren Rand des Glenoids rotiert und zeigt daher eine an eine Glühbirne erinnernde Kontur. Rechts die gleiche Schulter nach der Reposition.
Quelle (Link zu Lizenz und Urheber): Wikimedia commons
dortiger Autor: Hellerhoff (14.04.15)
Die Datei darf gemäß der Bestimmungen von Wikimedia commons weiter verwendet werden.

Typische Schulterluxation nach vorne unten.
Quelle (Link zu Lizenz und Urheber): Wikimedia commons
dortiger Autor: Hellerhoff
Die Datei darf gemäß der Bestimmungen von Wikimedia commons weiter verwendet werden.

Typische Schulterluxation nach vorne unten.
Quelle (Link zu Lizenz und Urheber): Wikimedia commons
dortiger Autor: Hellerhoff
Die Datei darf gemäß der Bestimmungen von Wikimedia commons weiter verwendet werden.
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Bei einem spinoglenoidalen Ganglion handelt es sich um einen raumfordernden Prozess im Bereich der dorsalen Scapulafläche in Richtung des Schultergelenkes. Dieses typische Entrapment-Syndrom der Schulter kann eine Druckschädigung des N. suprascapularis in der Incisura scapulae unter dem Lig. transversum scapulae superius hervorrufen. In manchen (selteneren) Fällen geschieht dieses auch in der supraglenoidalen Notch unter dem Lig. transversum scapulae inferius (=Lig. spinoglenoidale).

Neben anatomischen Normvarianten können auch hier repetitive Mikrotraumata bei Überkopfaktivität auslösend sein. Ursächlich ist vermutlich ein Ventilmechanismus, der durch okkulte posteriore oder superiore Labrumläsionen entsteht. So kann Flüssigkeit aus dem Gelenkraum in eine Kapselaussackung einströmen und das Ganglion bilden. Je nach Ausprägungsgrad und Lokalisation der Kompression liegen neben Schmerzsymptomen evtl. auch sichtbare Muskelatrophien vor.
Die Ganglien erreichen meist etwa 1-2 cm Durchmesser.
Symptomatik: (am häufigsten Männer im Alter von 30-50 Jahren)
-
Spontaner Schmerzbeginn ohne Trauma
-
Schmerzlokalisation „oben auf der Schulter oder hinten“
-
Schwäche der Außenrotation (je nach Grad der Schädigung)
-
Druckschmerz über der Zyste
-
Atrophie vom SSP (Lig. transversum scapulae superius), ISP und M. teres minor (beide ligamentären Engpässe möglich), Kompressionsneuropathie
-
Schmerz bei Überkopftätigkeit
Das MRT gilt als diagnostischer Goldstandard zur Identifikation der Schulterzysten, aber MSU kann ebenfalls geeignet sein, eine Zyste aufzuspüren.
Therapeutisch sollte neben der Dekompression (durch Entfernung der Zyste), der Labrumdefekt behoben werden.
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Bei freien Gelenkkörpern (osteochondrale Fragmente) handelt es sich in der Schulter oft um erbsengroße, runde Knorpel-/ Knochenstücke. Am Schultergelenk entstehen freie Gelenkkörper z.B. bei der Verrenkung durch Abschilferung von Knorpel oder im Rahmen der omarthrotischen Degeneration des Gelenks. Als synoviale Chondromatose entwickeln sie sich zudem (aber selten) aufgrund einer Erkrankung der Gelenkschleimhaut. Manche Fälle bleiben idiopathisch.
Die Symptomatik hängt von ihrer Lage und damit auslösenden Problemen ab:
-
Eventuell bildgebender Zufallsbefund
-
Blockierungen
-
Schnappen/Knacken im Gelenk
-
Reibung wie bei Omarthrose
-
Einklemmungschmerz, Schulterschmerz

Ein intraartikuläres Auftreten von Gelenkkörpern führt zu einem Abrieb des Knorpels vom Humerus und/oder Glenoid. Zunächst entstehen kleinere Knorpeldefekte, die langsam in einen flächigen Abrieb und schließlich in eine Omarthrose übergehen.
Diagnostisch genügt oft ein Röntgenbild und für eine genauere Darstellung von Lage und Anzahl, sollte ein CT veranlasst werden. Im MSU lassen sich eventuell erste Hinweise aufspüren.
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Frakturen des Caput humeri sind mit 5% aller Knochenbrüchen häufig anzutreffen und dabei meist resultierend aus traumatischen Ereignissen (oft Stürze). Die Stürze erfolgen auf den gestreckten Arm oder direkt auf die Schulter.
Eine begleitende Osteoporose ist dabei manchmal ein begünstigender Faktor.
Durch Tumoren oder Metastasen kann es auch zu einem spontanen Brechen ohne traumatisches Ereignis kommen (sog. Pathologische Fraktur).
Die subcapitalen Humerusfrakturen ordnet man im Allgemeinen der Gruppe der „Caput humeri“- Frakturen zu.
In der Mehrzahl betreffen die Verletzungen Personen zwischen dem 60. und 80. Lebensjahr und dabei Frauen doppelt so häufig wie Männer.
Die arterielle Versorgung der Strukturen rund um das Schultergelenk, sowie des proximalen Oberarmknochens, erfolgt aus Ästen der A. axillaris und der A. brachialis, sowie aus dem Truncus thyreocervicalis.
Die Ernährung des Caput humeri erfolgt über ein Hauptgefäß, die A. arcuata, die im Sulcus intertubercularis in das Caput humeri eintritt und seinen Ursprung in der A. circumflexa anterior findet.
Nebengefäße bzw. periostal einstrahlende Gefäße können am Tuberculum minus beziehungsweise im Bereich des Collums anatomicum in den Humeruskopf eintreten. Es bestehen zudem Anastomosen zwischen den Versorgungsgebieten der Kopfgefäße und denen der A. nutriciae humeri, welche den Humerusschaft versorgen.
Entscheidend für die postfrakturelle Blutversorgung des Humeruskopfes sind der Frakturverlauf, die Anzahl der Fragmente und ihr Dislokationsgrad. Bei einer Fraktur durch das Collum anatomicum mit zusätzlichem Abriss des Tuberculum majus und minus, ist die A. arcuata in der Regel verletzt.
Kommt dabei noch eine Dislokation des Kopffragments gegenüber dem Schaftfragment hinzu, so ist der
Ernährung des Humeruskopfes extrem gefährdet und das Risiko einer resultierende Humeruskopfnekrose nimmt
zu.
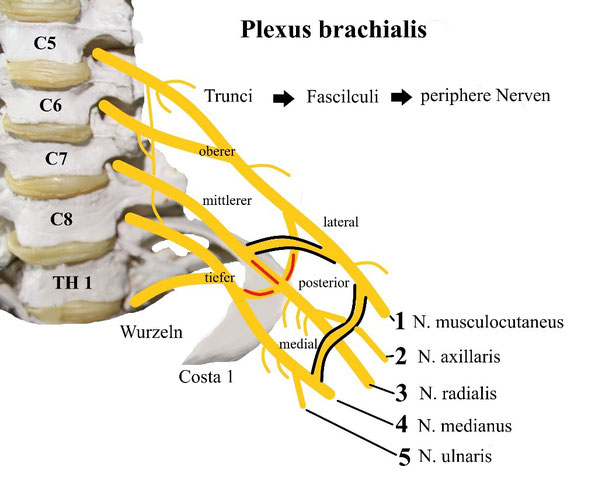
Die Schulter und der Arm werden vom Plexus brachialis innerviert. Aus dem Fasciculus posterior, der sich aus Teilen aller drei Trunci bildet, entspringt dann der N. axillaris.
Im Rahmen einer Fraktur des Caput humeri kann es zu einer Plexusschädigung kommen. Eine obere Plexusparese, die sog. Erb´sche Lähmung, manifestiert sich als Lähmung der Schultergürtelmuskulatur.
Eine untere Plexusparese (Klumpke-Lähmung) führt hingegen zu distalen Symptomen (Schwurhand/ N. medianus, Krallenhand/N. ulnaris und Fallhand/ N. radialis).
Es gibt verschiedene Klassifikationen von denen wir Neer (und Codman), sowie die AO-Klassifikation vorstellen.
Codman nahm 1934 eine 4-Fragmenteinteilung vor:
A) Das Gelenkfragment (Kalotte)
B) Tuberculum Majus
C) Tuberculum Minus
D) Humerusschaftfraktur
Die Klassifizierung von Neer basiert auf Codemans Einteilung und berücksichtigt den Grad der Dislokation der vier Hauptfragmente (in Folge: „Teile“).
Die Prognose ist abhängig von der Teilezahl, dem Dislokationsgrad und der Höhe der Fraktur. Eine signifikante Dislokation ist mit einer Teiledifferenz größer als 1cm oder einer Abkippung von mehr als 45° beschrieben.
Die Frakturen werden lokalisationsunabhängig in 2-, 3- und 4-Teile-Frakturen klassifiziert. Liegt keine oder eine geringe Dislokation vor und ist die Fraktur dabei stabil, so handelt es sich nach Neer um eine 1-Teil-Fraktur, selbst wenn mehrere Teile vorliegen.
Diese Frakturen werden konservativ behandelt, da ausreichend Weichteilstabilisation, sowie Impaktion („Einkeilung“) vorliegt.
Bei den dislozierten, prognostisch ungünstigen Frakturen wird bei den 3- und 4-Teile-Frakturen keine Unterscheidung hinsichtlich des Frakturverlaufs im chirurgischem Collum gemacht, was von einigen Medizinern als Schwäche ausgemacht wird.
Getrennt führt Neer die „Head-Split-Brüche“ und Impressionsfrakturen der Kopfkalotte auf.

AO (Arbeitsgemeinschaft für Osteosynthesefragen) -Klassifikation:
Im Gegensatz zu Neer berücksichtigt die AO-Klassifikation die Höhe der Fraktur, mit der dadurch resultierenden Durchblutung des Humeruskopfes, was somit eine Einschätzung des Nekroserisikos vom Humerus zulässt. Die Einteilung erfolgt in drei Hauptgruppen (Schweregrad):
A) extraartikuläre, unifokale Fraktur (eher leichte Brüche)
B) extraartikuläre, bifokale Fraktur (mittelschwere Brüche)
C) artikuläre Fraktur (schwerwiegende Brüche)
Die Frakturen der drei Hauptgruppen werden wiederum in drei Untergruppen und drei Subspezifikationen eingeteilt.
Hierdurch können 27 morphologische Untergruppen definiert werden. Diese berücksichtigen die Fragmentzahl, das Ausmaß der Dislokation, die Impaktion und die Fragmentierung.
Trotz dieser Aufspaltung der Frakturmuster bleiben einige Frakturen unberücksichtigt (z.B. isolierte Tuberculum Minus-Fraktur) und die Vielfalt kann im klinischen Alltag unübersichtlich sein. Im SFT-Konzept gibt der MSU nur erste Frakturhinweise für eine weiterführende bildgebende Differenzierung.
Symptomatik:
-
Starke Schmerzen mit Bewegungseinschränkung in allen Ebenen
-
Arm in Schonhaltung am Körper, in Ellenbogenbeugung
-
Großer Bluterguss im Schulter-Arm-Bereich möglich
-
Druckschmerzhaftigkeit
(Quellen: 1. Handoll HH, et al, Interventions for treating proximal humeral fractures in adults, Cochrane Database Syst Rev, (11):CD000434, 2015/ 2. Patel S, et al; Post-traumatic osteonecrosis of the proximal humerus, Injury; 46(10):1878-1884, 2015/ 3. Jobin CM, et al, Reverse shoulder arthroplasty for the management of proximal humerus fractures, J Am Acad Orthop Surg, 23(3):190-210; 2015/ 4. Maier D, et al, Proximal humeral fracture treatment in adults, J Bone Joint Surg Am, 96(3):251-261, 2014)
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Scapulafrakturen machen nur etwa 0,4-1% aller Frakturen aus, sind aber stets das Resultat großer Krafteinwirkung und fast immer mit Begleitverletzungen verbunden. Insofern sollte die körperliche Untersuchung insbesondere auch die Suche nach relevanten Begleitverletzungen (Plexus, Gefäße) beinhalten. Häufig kann aber eine konservative Therapie erfolgen, sofern keine Frakturdislokationen oder Schultergürtelinstabilitäten vorliegen.
Die Mehrzahl der Verletzungen resultiert aus Hochrasanztraumen bei Männern, das Alter liegt meist zwischen 25 und 42 Jahren.
Direkte, stumpfe Gewalt ist verantwortlich für Verletzungen des Schulterblattes und indirekte Kraftweiterleitung über den Arm führt zu Frakturen des Schulterblatthalses, Glenoids, sowie der Fortsätze. Maximale Krafteinwirkung kann zu Scapulothorakaler Dissoziation führen (Armamputation mit Abriss neurovaskulärer Strukturen). Scapulafrakturen werden vor allem wegen der oft lebensbedrohlichen Primärverletzungen übersehen (Kopf, Thorax).
Zur Beurteilung der Stabilität des Schulterkomplexes bei zusätzlichen ipsilateralen Verletzungen (z.B. Clavicula, ACG) wurde 1993 von Goss et al. Der Begriff SSSC (Superior Suspensory Shoulder Complex) eingeführt.
Dabei wird ein „Ring aus Knochen- und Bandstrukturen“ beschrieben, der drei Komponenten beinhaltet:
1. „Strebe“: Clavicula/Acromion/ ACG
2. Verbindung Clavicula und Processus coracoideus über Ligamente
3. “knöcherne Strebe von Glenoid, Spina scapulae und Processus coracoideus
Bei Verletzungen von 2 oder mehr Strukturen des SSSC wird von einer Instabilität im Schultergürtel ausgegangen. Diagnostisch finden sich Bewegungseinschränkungen und Schmerzen des Schultergürtels. Zudem liegen Hämatome, Schürfwunden und aufgrund der Mehrfachverletzungen oft Überlagerungen aus anderen Regionen vor.
Die Scapulafrakturen werden nach Euler und Rüedi (1993) klassifiziert, die Glenoidfrakturen nach Ideberg. SFT stellt nachfolgend nur eine Kurzübersicht der Glenoidfrakturen dar.

Quellen: Frakturen der Skapula, Jan Friederichs, Volker Bühren Priv.-Doz.Dr.med. Jan Friederichs Oberarzt, Prof.Dr. med. Volker Bühren Ärztlicher Direktor
BG Unfallklinik Murnau Prof.-Küntscher-Str. 8 82418 Murnau
1 Cole PA, Gauger EM, Schroder LK. Managementofscapular fractures.JAmAcadOrthop Surg 2012; 20: 130–141 2 Wiedemann E. Frakturen der Skapula. Unfallchirurg 2004; 107: 1124–1133 3 Goss TP. Double disruptions of the superior shoulder complex. J Orthop Trauma 1993; 7: 99–106 4 Lapner PC, Uhthoff HK, Papp S. Scapula fractures.Orthop Clin N Am 2008; 39: 459–474 5 Williams GR, Naranja J, Klimkiewicz J et al. The floating shoulder: a biomechanical basis for classification and management. J Bone Joint Surg [Am] 2001; 83: 1182–1187 6 Euler E, Rüedi T. Skapulafraktur. In: HabermeyerP,SchweibererL, Hrsg.Schulterchirurgie. 2.Aufl. München: Urban & Schwarzenberg; 1996: 261–272 7 IdebergR,GrevstenS,LarssonS.Epidemiology of scapular fractures. Incidence and classification of 338 fractures. Acta Orthop Scand 1995; 66: 395–397
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Arthrosen der oberen Extremität haben einen etwas anderen Charakter als degenerative Erkrankungen der unteren Extremität. Das Schultergelenk erfährt nicht so viel Belastung im geschlossenen System, wie z.B. die Sprunggelenke, Kniegelenke und Hüften. Es werden wesentlich weniger Prothesen verbaut, als an der unteren Extremität.
Patienten entwickeln Omarthrosen in der Regel auch erst nach dem 65. Lebensjahr und sind damit im Schnitt etwas älter, als beim Auftreten von Gonarthrosen und Coxarthrosen. Manchmal können sich Patienten mit fortgeschrittener Omarthrose in ihrem Alltag noch ausreichend arrangieren und verzichten auf größere Belastungen und Bewegungsumfänge.
Sobald aber ein störender Ruheschmerz persistiert und die Nächte kürzer werden, kann eine Omarthrose sich sehr lebenseinschränkend auswirken. In vielen Fällen können Verletzungen der Rotatorenmanschette ursächlich sein und Frakturen des Caput humeri oder Glenoids. Kam es traumatisch zu vaskulären Schäden mit der Folge einer knöcherne Minderdurchblutung oder zu einer neurogenen Verletzung mit resultierenden muskulären Instabilitäten, so ist der Weg für eine Degeneration ebenfalls geebnet. Arthritis, Rheuma oder bakterielle Infektionen können genau wie die kontinuierliche Überlastung des Gelenkes den Verschleiß des Gelenkes beschleunigen.
Labrumläsionen mit Stabilitätsverlust oder freie Gelenkkörper sind weitere auslösende Faktoren.
Patienten spüren eine langsam zunehmende Schmerzhaftigkeit und Einschränkung ihres Bewegungsradius in alle Richtungen. Im Alltag werden die Griffe ins höhere Regal schwierig und der Kleidungswechsel kann durch die hohe Rotationserfordernis beschwerlich werden. Zudem reduziert sich die Kraft merklich.
Bei den Bewegungen können „Knack- und Schnappgeräusche“ hörbar, wie fühlbar sein. Diese können dabei im Vergleich zu anderen Krepitationsgeräuschen durchaus auch schmerzhaft sein. Patienten mit einer Omarthrose sind in den Bewegungsabläufen manchmal vergleichbar wie Menschen mit einer Totalruptur der Rotatorenmanschette; zum Teil leiden sie auch unter beidem. Bekanntlich mögen arthrotische Gelenke keinen spontanen und kontinuierlichen Druck, so dass nächtliches Umdrehen oder „auf der Schulter liegen“ beschwerlicher wird.
Da degenerative Prozesse mit einem Verlust der Knorpelsubstanz einhergehen, ist die frühzeitige Einleitung gelenkerhaltener Maßnahmen entscheidend für die Prognose. Die zunehmende Erweichung des Knorpel, infolge Anstieg seines Wasseranteils, führt zu geringerer Belastungsfähigkeit. Wenn sich hieraus freie Gelenkkörper lösen, kann es einerseits zu chondralen Schäden kommen und anderseits auch zu entzündlichen Episoden (aktivierte Arthrose). Insgesamt spielen Impacts eine viel kleiner Rolle bei der Omarthrose, wie bei den Arthrosen der unteren Extremität.
Bei nahezu der Hälfte aller Patienten mit Omarthrose kommt es zu einer posterioren Subluxation des Caput humeri. Der Humeruskopf ist hierbei an den hinteren Pfannenrand gedrückt, infolge einer Versteifung der Gelenkkapsel. So haben die Patienten besonders bei Rotationsbewegungen Schwierigkeiten (Kapselmuster), was zudem mit den Verletzungen der Rotatorenmanschette zusammenhängen kann. Diese posteriore „Anpresszone“ ist dann auch die am häufigsten betroffene Arthrose-Region des Schultergelenkes.
Häufig treten Schmerzen erst im fortgeschrittenen Stadium auf, wenn die chondralen Defekte so groß sind, dass Gelenkflüssigkeit in den Knochen drängen kann und dort zur Zystenbildung führt. Diese Prozesse bewirken ,wie die durch Osteophyten einsetzende Vergrößerung der Gelenkflächen, wiederum eine Verstärkung der Inkongruenz.
Die Führung des Gelenkes kann durch muskuläre Dysbalance, fehlende äußere Stabilität (Knochen, Labrum) und Reduktion der Adhäsionskräfte so schlecht werden, dass der Oberarmkopf an das Schulterdach (siehe Impingement) anschlägt. In diesem Fall wird auch von einer Defektarthropathie (Cuffarthropathie) gesprochen.
Die irreparable Rotatorenmanschettenruptur mit schmerzhafter Pseudoparalyse stellt eine große therapeutische Herausforderung dar. Ausgedehnten Rupturen der Rotatorenmanschette gehen je nach Fortschreiten der Erkrankung mit verschiedenen Veränderungen des Glenohumeralgelenkes und des Subacromialraumes einher. Durch den Ausfall der zentrierenden und stabilisierenden Rotatorenmanschette kann es im Verlauf zu einer Migration (Wanderung) des Humeruskopfes nach kranial kommen, was sich bis zu einer Subluxation des Humeruskopfes nach antero-superior ausweiten kann. Durch den Zug des M. deltoideus nach kranial bei einhergehendem Ausfall der Zentrierung kommt es zu speziellen arthrotischen Veränderungen des Glenohumeralgelenkes und begleitend zu einer Arrosion der Unterfläche des Acromions. Die Veränderungen können auf Seiten des Oberarmes im Endstadium zu einem Kollaps des Humeruskopfes führen.
Omarthrose:
-
Humeruskopfhochstand
-
Gelenkspalt nahezu aufgehoben
-
Subchondrale Sklerosierung
-
Osteophytäre Anbauten

Omarthrose:
Verschmälerung des Gelenkspaltes und vermehrte Sklerosierung der subchondralen Lamellen. Periartikuläre Verkalkungen und ossäre Ausziehungen vor allem am Unterrand des Humerus. Der Subakromiale Raum ist noch weitgehend erhalten. Eine Läsion der Rotatorenmanschette gehört nicht zwingend zur Omarthrose, auch wenn beides oft vergesellschaftet ist.
Quelle zu Lizenz und Urheber: Wikimedia commons
dortiger Autor: Hellerhoff (22.01.2015)
Diese Datei darf gemäß der Bestimmungen von Wikimedia commons verwendet werden.

Omarthrose (oben) im Vergleich zu gesunder Schulter
Quelle zu Lizenz und Urheber: Wikimedia commons (Praxis Dr. Jochen Lengerke)
dortiger Autor: Dr. Jochen Lengerke
Diese Datei darf gemäß der Bestimmungen von Wikimedia commons verwendet werden.

Omarthrose, also Arthrose des Schultergelenks in der Röntgenaufnahme. Praktisch aufgehobener Gelenkspalt und vermehrte Sklerosierung der eigentlich knorpeltragenden Knochenoberflächen des Humerus und des Glenoids. Beginnende intraossäre Zystenbildung und ossäre Ausziehungen vor allem am Unterrand des Humerus.
Quelle zu Lizenz und Urheber: Wikimedia commons
dortiger Autor: Hellerhoff (07.02.2015)
Diese Datei darf gemäß der Bestimmungen von Wikimedia commons verwendet werden.
linke Schulter (true ap/ transglenoidal + Y-Aufnahme/ transscapulär)
80 jährige Frau mit Omarthrose bei SSP-Ruptur.
Schulter/ regio-strukturell 4: Glenohumeralgelenk, Ligamente, Labrum und Knochen
-
Anterior, superiores und posterior, superiores Impingement (Non-Outlet)
-
SLAP-Läsion (siehe Region 3)
-
Läsionen des Labrum glenoidale
-
Luxation der Schulter, Instabilitäten, Bankart-Läsion
-
Spinoglenoidales Ganglion
-
Freie Gelenkkörper
-
Frakturen des Caput humeri
-
Scapulafrakturen, Frakturen der Cavitas glenoidale
-
Omarthrose
-
Morbus Hass (Humeruskopf- Nekrose)
-
Arthritis
Die Osteonekrose des Humeruskopfes ist ein selten auftretendes Krankheitsbild, welches z.B. idiopathisch (Morbus Hass) oder posttraumatisch bedingt sein kann.
Durch eine Minderdurchblutung des Humeruskopfes kommt es zum Knochenzelltod mit der Folge des totalen Absterbens. Bei rechtzeitigem Erkennen eines frühen Stadiums haben minimalinvasive Therapieformen ihre Berechtigung. Bei fortgeschrittenem Stadium sollte die Wahl des richtigen endoprothetischen Ersatzes erfolgen, bevor Schultersteife und entzündliche Komponenten das postoperative Resultat schmälern.
Die Humeruskopfnekrose (HKN) unterliegt anderen Gesetzen als die Femurkopfnekrose (FKN), da die obere Extremität einer geringeren Gewichtsbelastung unterworfen ist. Auch kann das Glenoid einer größeren Deformierung standhalten, als das Acetabulum. Aus beiden Punkten resultiert, dass die HKN oft erst spät bemerkt wird, was durch Kompensationsmechanismen der Schulternebengelenke unterstützt wird. Somit bleiben frühe Krankheitsstadien oft unerkannt und die therapeutische Konsequenz bedeutet oft den unvermeidlichen Gelenkersatz.
Die HKN wird in zwei große Gruppen eingeteilt, nämlich die primären und sekundären Nekrosen. Zu den primären Gruppen zählt man die idiopathische HKN und die OCD (Osteochondrosis dissecans). Eine sekundäre HKN kann posttraumatisch oder aus systemischen Erkrankungen entspringen.
Ätiologisch zieht man neben den traumatischen Faktoren, verschiedene weitere für die Entstehung der HKN in Betracht, nämlich:
-
Kortikosteroide (Hypofibrinolyse des Plasmas, Reduktion der fibrinolytischen Aktivität der Endothelzelle, Vaskulitiden und Fettembolien intraossärer Gefäße) Letztlich wird nach längerer Kortikosteroid-Therapie die Schwächung des Knochens in seiner trabekulären Struktur angenommen, die zu frühzeitigen Stressfrakturen einzelner Trabekel und damit osteonekrotischen Veränderungen führen kann. Über die Höhe einer Kortikosteroidgabe zur Induktion einer HKN herrscht ebenso wenig Einigkeit wie zur Dauer einer Dosierung
-
Alkoholabusus
-
Nikotin (lokale Vasospasmen)
-
Potenzierung bei Alkoholabusus und Nikotin
-
Diabetes mellitus, Gicht, M. Gaucher (Fettstoffwechselstörung), Pankreatitis, Ionisierende Strahlung, Schwangerschaft
Über die frühen Stadien liegen nur unzureichende Informationen vor, da meist erst die späten Stadien entdeckt werden. Im Gefäßsystem werden verschiedene Störungen diskutiert:
1. Arterielle Insuffizienz (Unterbrechung der arteriellen Versorgung)
2. Störung der intraossären Zirkulation (Arteriolen)
3. Störung des intraossären venösen Abflusses mit sekundärer arterieller Insuffizienz
4. Extraossäre, tiefe Venenthrombose
5. Primäre intraossäre, extravaskuläre Störung mit der Folge von Minderdurchblutung (Kapillartamponade)
6. Zytotoxische Faktoren
Die sich pathomorphologisch abspielenden Prozesse sind grundsätzlich für alle Arten der Osteonekrose gleich, auch wenn unterschiedliche Prozesse der auslösenden Krankheit existieren. Auch die verschiedensten Lokalisationen der Osteonekrosen in allen Lebensabschnitten unterscheiden sich nicht in der Pathomorphologie.
Die Prognose, der Verlauf und die therapeutischen Ansätze sind jedoch in den verschiedenen Altersgruppen sehr unterschiedlich.
Im Vergleich zu den FKN, ist die HKN wesentlich seltener. Liegt allerdings eine HKN vor, so ist oft auch eine FKN anzutreffen. Beim Auftreten multilokaler Osteonekrosen, ist oft eine bilaterale HKN vorhanden.
Klassifikation nach ARCO (Association Research Circulation Osseous), gültig für HKN und FKN:
Stadium 1: radiologisch unauffällig, Signalintensitätsminderung in T1, im MRT Ödem
Stadium 2: radiologisch Sklerose des cranialen Humeruskopfes, im MRT beginnende subchondrale Osteolysen, Signalminderung
Stadium 3: „Halbmondzeichen“: subchondrale Fraktur durch nekrotischen und reparierten Knochen im MRT. Entrundung der Humeruskopfkontur im Röntgenbild
Stadium 4: Kollaps des subchondralen Knochens, Ausbildung einer sekundären Arthritis, intraartikulärer Erguss im MRT
Stadium 5: glenoidale Arthritis mit fortschreitender Gelenkzerstörung
Das klinische Bild ist lange unauffällig, da sich gravierende Anzeichen, wie Schultersteife, Abduktionsschmerzen und Gelenkreibung erst bei chondraler Schädigung im Spätstadium manifestieren.
Der Einsatz der Bildgebung zur Aufklärung von frühen Stadien ist schwierig. Zur genauen Ermittlung der Knochenperfusion ist ein dynamisches Kernspintomogramm unter Einsatz von Kontrastmitteln notwendig. Die konservative Therapie ist begrenzt, da die Krankheit meist in späten Stadien entdeckt wird. Weil es sich aber oft um junges Patientengut handelt und die betroffene Extremität weitgehend ohne Gewichtsbelastung geschont werden kann, ist ein Abwarten im Stadium 1 und 2 berechtigt. Des weiteren kommen stadien- und klientelabhängig, gelenkerhaltende oder -ersetzende Operationen zur Anwendung.
Bilder: Humeruskopfnekrose
Eine Arthritis der Schulter tritt im Vergleich zum Knie- oder Hüftgelenk seltener auf. Der Ablauf ist im Hüftkapitel nachzulesen.
Quellen: T. Schneider C. Fink R. Schmidt-Wiethoff: Die Humeruskopfnekrose. Obere Extremität 3:84–91 (2008) DOI 10.1007/s11678-008-0085-2. Prof. Dr. T. Schneider, Dreifaltigkeits-Krankenhaus Köln Klinik für Orthopädie, Unfallchirurgie und Sporttraumatologie Aachener Str. 445 50933 Köln, Germany C. Fink St. Augustinus Krankenhaus Düren Renkerstr. 45 52355 Düren, Germany R. Schmidt-Wiethoff Arcus Sportklinik Pforzheim Rastatter Str. 17–19 75179 Pforzheim, Germany/ Die Humeruskopfnekrose, Obere Extremität 2 2008, z.B.:
Bloem J (1988) Transient osteoporosis of the hip: MR imaging. Radiology 167: 753–755 2. Brozna JP (1990) Shwartzman reaction. Semin Thromb Hemost 16:326–332 3. Cruess RL (1986) Osteonecrosis of bone. Current concepts as to etiology and pathogenesis. Clin Orthop Rel Res 208:30–39 4. Cushner MA, Friedman RJ (1997) Osteonecrosis of the humeral head. J Am Acad Orthop Surg 5:339–346 5. David HG, Bridgman SA, Davies SC, Hine AL, Emery RJH (1993) The shoulder in sickle-cell disease. J Bone Joint Surg Br 75:538–545 6. Drescher W, Li H, Jensen SD, Ingerslev J, Hansen ES, Hauge EM, Bunger C (2002) The effect of long-term methylprednisolone treatment on the femoral head in growing pigs. J Orthop Res 20: 662–668 7. Drescher W, Schneider T, Becker C, Hobolth J, Ruther W, Hansen ES, Bunger C (2001) Selective reduction of bone blood flow by short-term treatment with high-dose methylprednisolone. An experimental study in pigs. J Bone Joint Surg Br 83:274–277)





